دکتر مریم قوام (استادیار گروه آموزشی ترمیمی)- دکتر فاطمه مهندس - زهرا آجرلو
. ترمیمهای کامپازیت خلفی مزایایی چند نسبت به آمالگام دارند که از آن میان میتوان به زیبایی, عدم حضور جیوه, و قابلیت باند ( اتصال ) این مواد به دندان نام برد. تحقیقات متعددی نشان داده است که این قابلیت باند میتواند علاوه بر کاهش میکرولیکیج و افزایش گیر, در استحکام بخشی به نسجهای باقیمانده دندان هم مؤثر باشد.
امروزه انواع متعددی از کامپازیتها به بازار ارائه شده است که بخوبی در نواحی خلفی قابلیت کاربرد دارند ولی قبل از اینکه بتوان بطور روزمره از این مواد در نواحی خلفی دهان استفاده کرد, باید بر دومشکل مهم فائق بیاییم:
تکنیک کامپازیت خلفی:
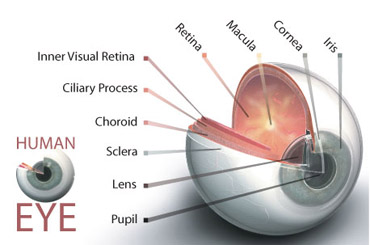
در تصویر زیر نمای اکلوزال کوادرادنت چپ ماگزیلا را در یک بیمار جوان نشان میدهد.
ضایعات پوسیده مزیال و دیستالی در اولین پرمولر مشاهده میشود. یک ترمیم MOD کامپازیت خلفی در این مورد اندیکاسیون پیدا میکند.
Prewedging:
بعد از ایزولاسیون و قبل از تراش, عمل Prewedging را انجام میدهیم
عمل Prewedging دو هدف را فراهم میکند:
1) سبب جداشدن تدریجی دندانها از هم میشود تا فضای کافی برای ماتریس سلولوئیدی فراهم شود.
2) قسمت اکلوزالی وج، راهنمایی برای قراردادن کف ژنژیوپروکسیمالی حفره کلاس II میشود. درمواردی که کف ژنژیوال کلاس II, به CEJ رسیده باشد, ترمیم کامپازیت به تنهایی اندیکاسیون ندارد. در این موارد, ایجاد Seal قابل اطمینان مشکل است. در چنین مواردی سمان گلاس آینومر به مارجین سمان دندان اتصال مییابد و بقیه ترمیم با کامپازیت صورت میگیرد. حتی از آمالگام هم در ناحیه ژنژیوال زیر کامپازیت میتوان استفاده کرد.
تراش حفره:
تراش حفره کلاس II کامپازیت حتیالامکان محافظهکارانه صورت میگیرد. برخی از محققین تراش Cavosurface را بصورت بدون bevel و90 درجه 0توصیه کردهاند. زیرا تراش bevel, مارجین نازکی از کامپازیت را در ناحیه Cavosurface ایجاد میکند که میتواند در معرض شکستگی قرار بگیرد و ایجاد ledge کند.
1- اثرات سمی مواد کامپازیت روی پالپ
2- اچ شدن اجتنابناپذیر عاج با اسید
3- انقباض پلیمریزاسیون کامپازیتها
محافظت پالپ:
در ترمیمهای کامپوزیت خلفی, حفاظت از پالپ به 4 دلیل زیر اهمیت دارد:
1- اثرات سمی مواد کامپازیت روی پالپ
2- اچ شدن اجتنابناپذیر عاج با اسید
3- انقباض پلیمریزاسیون کامپازیتها
4- میکرولیکیج و نفوذ باکتریها
هرچند در برخی از این موارد تناقض آرا وجود دارد, ولی در 2 مورد انقباض پلیمریزاسیون و میکرولیکیج شواهد روزافزونی در دسترس است امروزه درصورتی که seal معتبری در حد فاصل ترمیم و دندان باشد. امروزه اگر Seal مطمئن بین ترمیم کامپازیت و دندان باشد, اهمیتی ندارد که عاج اچ شود. در رابطه با محاظت پالپ اگر اکسپوژر رخ دهد, و یا اگر حفره خیلی عمیق باشد و مجاور پالپ باشد (نقطه صورتی دیده شود), از ترکیبات Ca(OH)2, بخصوص انواع نوری آن میتوان استفاده کرد. از سایر موادی که در این موارد میتوان استفاده کرد, سیمانهای گلاسآینومر selfو یا گلاسآینومر نوری است. کاربرد گلاسآینومرها در زیر ترمیمهای خلفی کامپازیت سبب کاهش میکرولیکیج, کاهش فعالیت میکروبی و کاهش پوسیدگی ثانویه میشوند.
Bond Resin applicator: بعد از ایزوله کردن استفاده از مواد باندینگ بخصوص نسلهای جدید, طبق دستور کارخانه صورت میگیرد. میتوان قبل از این مرحله ماتریس و وج گذاشت ولی برخی از کلینیسینها وج و ماتریس را پس از زدن باندینگ, قرار میدهند.
قرار دادن کامپازیت:
به منظور کاهش استرسهای انقباض ناشی از پلیمریزاسیون کامپازیت را بصورت لایه لایه در حفره قرار میدهیم و هر قطعه را بصورت مجزا, Cure میکنیم.
کامپازیتهای خلفی ترجیحاً بهتر است قابل کاندنس شدن باشد. مثل PSO, Hercutite و Prisma APW.
درهنگام Cure کردن باید دقت شود که دستگاه شدت کافی داشته و نوک خروجی نور در کمترین فاصله (5/0 میلیمتر) از کامپازیت باشد.
در یک حفره متوسط کلاس II کامپازیت 2 یا 3 قطعه کامپازیت در حفره قرار داده شده و سخت میشود.
برخی از اشکالاتی که در کامپازیت خلفی گزارش شده است سایش بیشتر، بازماندن کنتاکت. Cure نشدن ماده, و حساسیت پس از درمان است. امروزه با تغییراتی که در ترکیب شیمیایی رزین, نوع و اندازه فیلر, و روشهای Curing داده شده است.
سایش این مواد بهبود یافته است. روشهای کار نظیر استفاده از ماتریسها و Sectional و عمل Prewedging در بستن موفقیتآمیز کنتاکت مؤثر است.
رعایت شدن مناسب و فاصله صحیح دستگاه لایت کیور از سطح رزین و رعایت زمان کافی و ضخامتهای حداکثر 2 میلیمتر, در Curing ماده کمک میکند
Post operative sensitive
معمولاً 8 دلیل برای حساسیت این ترمیمها پس از درمان ذکر میشود:
1- ترامای ترمیم 2) صدمات قبلی به دندان 3) اثرات سمی کامپازیت 4) اچ شدن عاج با اسیدفسفریک 5) Under cure 6) هایپر اکلوژن 7) انقباض پلیمریزاسیون 8) میکرولیکیج.
درمجموع با کنترل انقباض پلیمریزاسیون, و کاهش لیکیج, میتوان تا حد زیادی کنترل حساسیت را بدست گرفت.
روابط عمومی دانشگاه علوم پزشکی تهران
پست الکترونیکی: Rahimi@anzymite.com-Tel: 0912 1079083
کیتین: پلیمر طبیعی،درمانگر زخم
کیتین، فراوانترین پلیمر طبیعی بعد از سلولز است. پلی ساکارید ازت داری است که ، در آن گلوکز،آمونیاک و اسید استیک به صورت مولکولهای گلوکز آمین وجود دارد.
کیتین، ماده خام فراوانی است که ، توسط سلولهای زنده گیاهی و جانوری ساخته میشود، و برای تبدیل به مواد شیمیایی و محصولات جدید عملا تمام نشدنی است. این نوع مواد زیستی به علت برتریها و مزیتهای طبیعی و ذاتی،آینده درخشانی دارند. کیتین ماده با ارزشی است که، استفادههای صنعتی، شیمیایی، پزشکی، دارویی ،آرایشی و بهداشتی دارد.

در مجاورت محلول سدیم هیدروکسید غلیظ و گرما گروههای استیل آمینو کیتین(ACNH-) به عاملهای آمینی (-NH2) تبدیل میشوند. به این طریق میتوان گفت از فرم دی استیله شده کیتین،ترکیبات مختلف کیتوسان را تهیه میشود.
منابع تولید کننده کیتین و کیتوسان عبارتند از: میگو، خرچنگ، لابستر، کریل، صدفهای دو کفه ای، ماهی مرکب، اسکوئید،کلم، مرجانهای آب شیرین، دیاتومه، جلبکها، حشرات و قارچ ها.
کیتین و کیتوسان تعدادی خواص بیولوژیک مفیدی مانند زیست سازگاری بالا و قابلیت زیست تخریب پذیری در کاربرد هایی نظیر : پوشش زخم ها، عاملهای انعقاد خون، عاملهای ضد عفونت و عاملهای تسریع در ترمیم زخم دارند.
در این تحقیق اثر کیتین و کیتوسان روی ترمیم زخم بررسی شده و این نتیجه حاصل شده است، که این مواد سیستمهای ترمیم و سلولهای (PMN) Polymorphonuclear و فیبروبلاستها و سلولهای اندوتلیال رگها را فعال میکنند.
وقتی کیتین و کیتوسان در بدن استفاده میشوند، توسط آنزیمهای کیتیناز و کیتوساناز تخریب میشوند و متعاقبا به منومر و الیگومرهایشان تبدیل میشوند. در تحقیقات گذشته ثابت شده که نه تنها کیتین و کیتوسان بلکه الیگومرها و منومرهای آنها نیز روی مهاجرت سلولهای اندوتلیال و فیبروبلاستها اثر داشته و بر روی ترمیم زخمها در محیط in-vivo موثرند. هر چند که رابطة بین خواص شیمیایی کیتین/کیتوسان و ترمیم زخم هنوز شناخته نشده است. در تحقیق حاضر کیتین و کیتوسان با وزنهای مولکولی و DDهای مختلف آماده شده اند و اثر آنها روی ترمیم زخمهای برشی ایجاد شده در موشها آزمایش شده، و همچنین استحکام زخم ترمیم شده و میزان آنزیم کلاژناز در بافت هم اندازه گیری شده است، که این دو به عنوان شاخصی برای ترمیم زخم هستند.
آزمایشات 
مواد استفاده شده
در این پژوهش از منومر کیتین(Gl¬c¬NA c¬)، الیگومر کیتین (NACOS) و پلیمر کیتین و همچنین از منومر کیتوسان (Gl¬c¬N)، الیگومر کیتوسان (COS)و پلیمر کیتوسان استفاده شد.
کیتین ( باوزن مولکولی 300KD ) و کیتوسان ( با وزن مولکولی 80KD ) با میانگین سایز 5/3 میکرو متر به وسیله گاز اتیلن اکساید استریل شدند و در محلول بافر فسفات ( PBS با PH=7/2 ) با غلظت 10 میلی گرم بر میلی لیتر معلق میشوند. کیتین و کیتوسان به ترتیب شامل DDهای کمتر از 10 درصد و بیشتر از 80 درصد هستند .
الیگومرها و منومرها در محلول PBS با غلظت 10 میلی گرم بر میلی لیتر حل شدند و از فیلترهای با روزنههای 45/0 میکرو متر عبور کرده و استریل شدند، و سپس نمونهها در 3 غلظت، 1/0، 1 و 10 میلی گرم بر میلی لیتر با PBS تنظیم شدند.
چهار نمونه مختلف دی استیله شده کیتین (DAC) ( با 14% و 23% و 63% و 96% ) با یک وزن مولکولی یکسان (50KD) تهیه شد و به صورت پودری با میانگین سایز 6 تا 8 میکرومتر استریل شده و به همان روش تنظیم کیتین و کیتوسان تنظیم شدهاند، پودرها با DD 100% رابا (DAC100) نشان میدهند.
وزن مولکولی در این تحقیق توسط روش viscosity و DDهم توسط روش IR و یا روش colloidal titration تعیین شده است.
طرح آزمایش
از 72 عدد موش ماده Wistar ( با وزنی حدود 300±20gr ) در این تحقیق استفاده شده است. پس از اینکه موهای پشت موشها تراشیده و قسمت تراشیده شده با (یدI ) ضد عفونی شد، 2 زخم برشی ضخامت کامل (با طول 4 سانتی متر ) در حالت بی هوشی با چاقوی جراحی روی پشت موشها ایجاد میشود. پس از اینکه خونریزی متوقف شده با 100 میکرولیتر از هر نمونه زخم شتسشو داده میشود و سپس زخم با بخیه هایی از جنس Stainless Steel بخیه میشوند . هفت روز بعد از جراحی حیوانات اتانازی (کشته) میشوند و از بافت پوست در محل زخم نمونه برداری میشود. در بررسی استحکام زخم بهبودیافته یک نوار از پوست ( با 1 سانتی متر عرض و 2 سانتی متر طول ) از وسط محل زخم در هر نمونه برداشته میشود. حداکثر استحکام تا زمانی که پوست از محل برش پاره شود، با loud gauge و کششسنج اندازهگیری شد.
اطلاعات به دست آمده به سطح مؤثر تقسیم شده ( 5 میلی متر از خط برش در هر نمونه ) و در آخر بر حسب نیوتن بر میلی متر مربع بیان شده (N/mm2) ، در دیگر نمونهها ( نمونههای دوم ) میزان آنزیم کلاژناز با دستگاه اندازه گیری کلاژن نوع I اندازه گرفته شد و مشاهدات بافت شناسی نیز انجام گرفت.
تحلیلها
اثر وزن مولکولی روی استحکام بهبودیافته و فعالیت آنزیم کلاژناز
اثر وزن مولکولی روی استحکام زخم بهبود یافته در شکل 1 نشان داده شده است .
استحکام زخم بهبود یافته در همة نمونهها افزایش قابل توجه ای در مقایسه بانمونة شاهد (Saline) داشت. در گروه کیتین ( شامل : کیتین،GlCNAc ، NACOS) و کیتوسان ( شامل : کیتوسان و GLCN ، COS ) بیشترین تأثیر مربوط به الیگومرها (NACOS , COS) بود. وقتی گروههای کیتین و گروههای کتیوسان با هم مقایسه شدند، مشخص شد، که گروههای کیتوسان در یک وزن مولکولی یکسان اثر بیشتری از گروههای کیتین دارند، و همچنین اثر غلظت mg1/0 از بقیه غلظتها برای هر کدام از نمونهها بیشتر بود.
اثر وزن مولکولی روی فعالیت آنزیم کلاژناز در شکل 2 نشان داده شده است.
فعالیت آنزیم کلاژناز در همة نمونهها افزایش قابل توجه ای را در مقایسه با نمونه شاهد نشان داد و در گروههای کیتوسان منومرGLCN بیشترین تاثیر را داشت، در حالیکه در گروههای کیتین اختلاف زیادی وجود نداشت.
فعالیت آنزیم کلاژناز در گروههای کیتوسان بیشتر از گروههای کیتین است. اختلاف زیادی بین فعالیت آنزیم کلاژناز در غلظتهای مختلف نمونهها وجود نداشت ولی این میزان برای غلظت mg 1 کمی بیشتر از سایر غلظتها بود.
در یافتههای بافت شناسی مشخص شد، که در گروههای کیتوسان نسبت به گروههای کیتین فیبرو بلاستهای بیشتری در اطراف زخم بودند و فیبرهای کلاژنی در الیگومرها(NACOS,COS)به صورت عمود بر خط برش رشد کردند(شکل 3)، در حالیکه در نمونه شاهد و منومرها(,GLCNAC GLCN) این فیبرها به صورت موازی با خط برش رشد کردند(شکل 4).
این تحقیق نشان میدهد، که نه تنها کیتین و کیتوسان بلکه منومرها والیگومرهای آنها نیز سرعت ترمیم زخم را افزایش میدهند، هر چند که این قضیه کاملا آشکار نیست. به هر صورت کیتین و کیتوسان به علت اینکه به وسیله برخی از آنزیمها در محیط زخم به مونومرها و الیگومرهایشان تخریب میشوند، مستقیما در ترمیم زخم اثر گذارند، و در این تحقیق ثابت شده که الیگومرها تأثیر بیشتری دارند.
نمی توان به درستی توضیح داد، که چرا الیگومرها اثر بیشتری بر روی ترمیم زخم دارند . با وجود این یک جواب مطرح است: نمونه با سایز مولکولی مختلف در زخم استفاده شده و درجه تخریب برای هر نمونه متفاوت است، بنابراین در پلیمر کیتین و کیتوسان زمان بیشتری برای تخریب و جذب در زخم به علت وزن مولکولی بالا لازم است. در حالیکه منومرها به علت وزن مولکولی کم به سرعت جذب میشوند، به علاوه الیگومرها هم از این جهت مناسب هستند.
نه فقط کیتین و کیتوسان بلکه الیگومرها و منومرهایشان هم فعالیت آنزیم کلاژناز را افزایش میدهند. فعالیت آنزیم کلاژناز با تغییر شکل زخم در طی فرآیند ترمیم زخم رابطه دارد. این آنزیم به طور عمده توسط فیبروبلاستها و سلولهای التهابی تولید میشود. در مشاهدات بافت شناسی فیبروبلاستهای بیشتر و سلولهای التهابی کمتری در اطراف زخم دیده شده که نشان دهنده این است، که فیبروبلاستها به طور عمده آنزیم کلاژناز را تولید میکنند. این پدیده به این معنی است، که کیتین و کیتوسان و مواد حاصل از تخریب آنها بر روی شکل زخم در طی فرآیند ترمیم زخم تاثیر میگذارند. تحقیقاتی کلینیکی وجود دارد، که نشان میدهد که جای زخم در حضور کیتین و کیتوسان به حداقل میزان خود میرسد.
در این تحقیق رنج غلظت همه نمونهها از 1/0 تا 10 میلی گرم بر میلی لیتر، باعث افزایش سرعت ترمیم زخم شده و فعالیت آنزیم کلاژناز را نیز افزایش داده است.
از نمونهها با میزان غلظت 1/0 تا 10 میلی گرم بر میلی لیتر استفاده شده و 1/0 میلی لیتر از هر نمونه روی زخمها قرار داده شد، (4 سانتر متر * 1 سانتی متر سطح زخم) کمترین وزن هر نمونه 01/0 میلی گرم (10 میکروگرم) است. با توجه به اینکه همه غلظتها برای تسریع در بهبود زخم کافی هستند بنابراین برای بدست آوردن حداقل غلظت موثر باید اثر غلظتهای کمتر هم بررسی شود.
اثر DD روی استحکام زخمهای بهبودیافته و فعالیت کلاژناز
جدول 1 اثر DD را روی استحکام زخمهای بهبودیافته و فعالیت کلاژناز را نشان میدهد.
مقدار هر دو پارامتر در همه نمونهها افزایش قابل توجه ای نسبت به نمونه شاهد دارد.
هرچهDD بیشتر باشد، استحکام زخم بهبودیافته و فعالیت آنزیم کلاژناز بیشتر است، و همچنین در مطالعات بافت شناسی درDDهای بالا فیبروبلاستهای فعال شده بیشتری مشاهده شده است(شکل 5 و 6)
شکل 5 و 6
نتیجه گیری:
نتیجة این تحقیق با تحقیقات گذشته سازگار است. علاوه بر کیتین و کیتوسان منومرها و الیگومرهای آنها هم فرآیند ترمیم زخم را تسریع میکنند . استحکام زخم بهبودیافته و فعالیت آنزیم کلاژناز در گروههای کیتوسان بیشتر از گروههای کیتین است.
در مطالعات بافت شناسی مشخص شد که کلاژن در جهت عمود بر خط برش در گروههای الیگوساکارید (NACOS,CAS) رشد کرده و تعدادی فیبروبلاستهای فعال شده در اطراف زخم در گروههای کیتوسان نشان داده شد.
و در مورد درجه دی استیله شدن، هرچه این درجه بالاتر باشد استحکام زخم بهبودیافته و فعالیت فیبرو بلاستها افزایش بیشتری را نشان میدهند.
شکل 1) اثر وزن مولکولی روی استحکام زخم بهبودیافته
شکل 2) اثر وزن مولکولی روی فعالیت آنزیم کلاژناز
 وقتی به صورت آسیب های جدی وسخت وارد می شود، باعث ایجاد عیوب درسطح داخلی حفره استخوانی محتوی کره چشم می شود. شکستگی وآسیب جدی حفره های استخوانی محتوی کره چشم می تواند بیماری های جدی مثل دوبینی رادرفرد به وجود آورد. مدیریت واداره ایده آل شکستگی حفره های استخوانی کره چشم به موضوعی بسیاربحث انگیزتبدیل شده است. بسیاری ازایمپلنت های اوتوژنوزو آلوپلاستیک برای پوشش عیوب حفره ها استفاده شده اند. دراین تحقیق ترمیم این نوع عیوب با استفاده ازایمپلنت های شیشه ای زیست فعال بررسی می شود. شیشه های زیست فعال سیلیکات هایی هستند که شامل سدیم ،کلسیم وفسفات هستند. شیشه های زیست فعال ازطریق واکنش شیمیایی شیشه با یک لایه ازهیدروکسی آپاتیت با استخوان پیوند برقرارمی کند. واکنش های بلند مدت بین شیشه های زیست فعال واستخوان ،تداوم وپایداری آن درحفره های سینوسی پیشانی وگونه برای موفقیت درمان مهم هستند. شیشه های زیستی ازرشد باکتری ها هم جلوگیری می کند.ایمپلنت ها سخت هستند پس باید دراندازه درست انتخاب شوند تا برای قرارگیری درحفره مناسب باشند. اگرچه ایمپلنت ها درحین عمل جراحی مدل سازی نمی شوند ، وقتی دراندازه مناسب انتخاب شوند به هیچ ثابت سازی ویژه ای نیاز ندارند. 36 بیمارکه همگی دچارشکستگی حفره استخوانی کره چشم بودند، درسال 1999-1995 مورد معاینه قرار گرفتند. ایمپلنت های شیشه ای زیست فعال به صورت زیرمژگانی یا میان ملتحمه ای روی عیوب قرار گرفتند. برای ثابت سازی ازپیچ استفاده نشد. معاینات بعدی 1 و3 ماه پس ازعمل جراحی انجام گرفت و 28 نفرازبیماران (82%) هم یک سال پس ازجراحی معاینه شدند.(21 مرد و7 زن).
وقتی به صورت آسیب های جدی وسخت وارد می شود، باعث ایجاد عیوب درسطح داخلی حفره استخوانی محتوی کره چشم می شود. شکستگی وآسیب جدی حفره های استخوانی محتوی کره چشم می تواند بیماری های جدی مثل دوبینی رادرفرد به وجود آورد. مدیریت واداره ایده آل شکستگی حفره های استخوانی کره چشم به موضوعی بسیاربحث انگیزتبدیل شده است. بسیاری ازایمپلنت های اوتوژنوزو آلوپلاستیک برای پوشش عیوب حفره ها استفاده شده اند. دراین تحقیق ترمیم این نوع عیوب با استفاده ازایمپلنت های شیشه ای زیست فعال بررسی می شود. شیشه های زیست فعال سیلیکات هایی هستند که شامل سدیم ،کلسیم وفسفات هستند. شیشه های زیست فعال ازطریق واکنش شیمیایی شیشه با یک لایه ازهیدروکسی آپاتیت با استخوان پیوند برقرارمی کند. واکنش های بلند مدت بین شیشه های زیست فعال واستخوان ،تداوم وپایداری آن درحفره های سینوسی پیشانی وگونه برای موفقیت درمان مهم هستند. شیشه های زیستی ازرشد باکتری ها هم جلوگیری می کند.ایمپلنت ها سخت هستند پس باید دراندازه درست انتخاب شوند تا برای قرارگیری درحفره مناسب باشند. اگرچه ایمپلنت ها درحین عمل جراحی مدل سازی نمی شوند ، وقتی دراندازه مناسب انتخاب شوند به هیچ ثابت سازی ویژه ای نیاز ندارند. 36 بیمارکه همگی دچارشکستگی حفره استخوانی کره چشم بودند، درسال 1999-1995 مورد معاینه قرار گرفتند. ایمپلنت های شیشه ای زیست فعال به صورت زیرمژگانی یا میان ملتحمه ای روی عیوب قرار گرفتند. برای ثابت سازی ازپیچ استفاده نشد. معاینات بعدی 1 و3 ماه پس ازعمل جراحی انجام گرفت و 28 نفرازبیماران (82%) هم یک سال پس ازجراحی معاینه شدند.(21 مرد و7 زن).
نتایج حاصل ازاین معاینات به شکل زیراست:ایمپلنت های قرار داده شده دراستخوان یا بافت نرم سیستم ایمنی بدن را تحریک نکردند وهیچ نشانه ای ازلیزشدن یا عفونت وجود نداشت. پس ازعمل جراحی بیرون آمدگی، خونریزی وجا به جا شدگی ایمپلنت مشاهده نشد. 17 بیمار(61%) قبل ازعمل جراحی و5 بیمار(18%) پس ازعمل جراحی دوبینی داشتند. دریک بیمار، سه ماه پس ازعمل جراحی به دلیل دوبینی ایمپلنت را ازبدن خارج کردند. در9 بیمار(32%) قبل ازعمل جراحی و5 بیمار(18%) پس ازعمل جراحی حس منحرف کننده یا بیمارگونه مثل سوزش، گزگز درعصب زیرحفره استخوانی کره چشم اتفاق افتاد. نتایج ظاهری وعملی دریک سال خوب بودند.
نتیجه گیری: ایمپلنت های شیشه ای زیست فعال ماد مناسبی برای بازسازی حفره های استخوانی محتوی کره چشم هستند. ایمپلنت های شیشه ای زیست فعال زیست سازگاروزیست فعال هستند به همین دلیل محیط مساعد ومطلوبی را برای فرآیند ساده درمان فراهم می آورند وساختمان جدیدی ازاستخوان را به وجود می آورند.
ترجمه و ویرایش:حسین محمدی
|
عنوان : مزایای بیوپلیمر کلمات کلیدی: بیوپلیمر، پلیمرهای زیستی، باکتری، گیاه، تولیدکنندگان |
پلیمر های متداول امروزی از نفت خام ساخته می شوند که با توجه به محدود بودن منابع نفتی باید به تدریج با بیوپلیمر ها که از منابع تجدید شونده ساخته می شوند، جانشین شوند.
بیوپلیمر از نظر بیوشیمی دان ها عبارت است از ماکرومولکول های بیولوژی که از تعداد زیادی زیر واحد کوچک و شبیه به هم که با اتصال کووالانسی به هم متصل شده اند ویک زنجیره طولانی را ایجاد می کنند، ساخته شده اند.
پلیمر های متداول امروزی از نفت خام ساخته می شوند که با توجه به محدود بودن منابع نفتی باید به تدریج با بیوپلیمر ها که از منابع تجدید شونده ساخته می شوند، جانشین شوند. بیوپلیمر از نظر بیوشیمی دان ها عبارت است از ماکرومولکول های بیولوژی که از تعداد زیادی زیر واحد کوچک و شبیه به هم که با اتصال کووالانسی به هم متصل شده اند ویک زنجیره طولانی را ایجاد می کنند، ساخته شده اند.
در روند طبیعی، بیوپلیمر ها و یا همان ماکرومولکول ها، ترکیبات داخل سلولی هستند که قابلیت زنده ماندن را به ارگانیسم در شرایط سخت محیطی می دهند.مواد بیوپلیمری در شکل های گوناگونی توسعه یافته اند؛ بنابراین ظرفیت استفاده در صنایع گوناگون را دارند. توسعه مواد بیوپلیمری به چنددلیل اهمیت دارد. اول این که این مواد بر خلاف پلیمر های امروزی که از مواد نفتی به دست می آیند، به محیط زیست برگشت پذیر هستند؛ بنابراین موادآلوده کننده محیط زیست به شمار نمی آیند. در این خصوص مواد بیوپلیمری در ساخت پلاستیک ها به دو صورت استفاده قرار می شوند.
اول استفاده از پلاستیک هایی که درآنها یک ماده تخریب پذیر(مانند نشاسته) به یک پلاستیک متداول (مانندپلی اتیلن) اضافه می شود، درنتیجه این ماده به افزایش سرعت تخریب پلاستیک کمک می کند. این مواد چند سالی هست که وارد بازار شده اند و با آن که کمک زیادی به کاهش زباله های پلاستیکی کرده اند، اما به دلیل این که در آنها از همان پلاستیک های متداول تخریب ناپذیر استفاده می شود و استفاده از مقدار زیادی مواد تخریب پذیر در پلاستیک ویژگی آن را تضعیف می کند، موقعیت چندان محکمی ندارند.
دوم استفاده از پلاستیک های تخریب پذیر ذاتی است که به دلیل ساختمان شیمیایی خاص به وسیله باکتری ها، آب یا آنزیم ها در طبیعت تخریب می شوند و خیلی سریع تر از نوع اول به محیط زیست بر می گردند، دردرجه دوم اهمیت مواد بیوپلیمری به وسیله موجودات زنده ساخته می شوند و در نتیجه در چرخه ساخت و تجزیه مواد بیولوژیک قرار می گیرند، پس هیچ گاه منابع آن محدود و تمام شدنی نیست، در حالی که مواد پلیمری و پلاستیکی امروزی از سوخت های فسیلی ساخته می شود که منابع آن محدود و تمام شدنی است. هر چند این منابع در حال حاضر و به ویژه در کشور ما به وفور یافت می شوند، ولی روزی تمام خواهند شد. سومین مزیت بیوپلیمر ها، اقتصادی بودن این مواد است، زیرا تولید بیوپلیمر نیاز زیادی به کارخانه و صنعت پیشرفته ندارد و با حداقل امکانات می توان به تولید آن مبادرت ورزید. همچنین قیمت بالای نفت خام، کشور ها را به سوی استفاده از این مواد سوق داده است.
هر چند امروزه برای کاربردهای بسیار خاص مانند نخ بخیه جراحی(نخ بخیه حل شونده) به کار می روند، ولی دیری نخواهد پایید که به استفاده گسترده از این پلیمر ها توجه خواهد شد. سه گروه از موجودات زنده می توانند بیوپلیمرها را تولید کنند که عبارتند از:گیاهان، جانوران و میکروارگانیسم ها که از این میان گیاهان و میکروارگانیسم ها اهمیت بیشتری دارند.
گیاهان تولیدکننده
بیشترین تحقیقات بیوپلیمری روی مهندسی ژنتیک گیاهان تولیدکننده فیبر مانند کتان، کنف و ... متمرکز شده است. به عبارت دیگر، توسعه واکنش های مولکولی درون سلولی گیاهان که به تولید مواد بیوپلیمری منجر می شود، مورد توجه مهندسان ژنتیک و بیوتکنولوژی قرار گرفته است. مواد بیوپلیمری که در سلول های گیاهی ساخته می شود، بیشتر از جنس پلی هیدروکسی بوتیرات (PHB) است. این ماده از نظر خصوصیات فیزیکی و مکانیکی بسیار شبیه پلی پروپیلن حاصل از مواد نفتی است. امروزه با همسانه سازی کردن ژن تولید کننده پلیمر پلی هیدروکسی بوتیرات در گیاهان معمولی که قابلیت تولید بیوپلیمر را ندارند، توانسته اند این محصول پلیمری را به طور انبوه تولید کنند. گیاهان، نیشکر، یونجه، درخت خردل و ذرت برای تولید این بیوپلیمر از طریق مهندسی ژنتیک انتخاب شده اند که ژن تولید کننده این پلیمر به داخل ژنوم این گیاهان وارد می شود و گیاه یادشده را به ساختن بیوپلیمر پلی هیدروکسی بوتیرات قادرمی سازد.
ارگانیه های تولیدکننده بیوپلیمر ها
درحدود ?? سال قبل برای نخستین بار بیوپلیمر پلی هیدروکسی بوتیرات از باکتری باسیلوس مگاتریوم جدا سازی شد. ازآن پس دانشمندان بیوپلیمر به دنبال یافتن راه هایی هستند که تولیدات بیوپلیمری باکتریایی را توسعه دهند و به صورت تجاری درآورند.
بیوپلیمر هایی که سلول های باکتریایی قادر به تولید آن هستند و از آنها جداسازی شده اند، عبارتند از: پلی هیدروکسی آلکانوات (PHA)، پلی لاکتیک اسید (PLA) و پلی هیدروکسی بوتیرات (PHA). این بیوپلیمر ها از نظر خصوصیات فیزیکی به پلیمر های پلی استیلن و پلی پروپیلن شبیه هستند. بیوپلیمر های میکروبی در طبیعت به عنوان ترکیبات داخل سلولی میکروب ها یافت می شوند و بیشتر زمانی که باکتری ها در شرایط نامساعد محیطی قرار می گیرند، اقدام به تولید این مواد می کنند. این مواد در حالت طبیعی به عنوان یک منبع انرژی راحت و در دسترس عمل می کنند.
همچنین هنگامی که محیط اطراف باکتری غنی از کربن باشد و از نظر دیگر مواد غذایی مورد استفاده باکتری دچار کمبود باشد، باکتری اقدام به ساخت بیوپلیمر های یادشده می کند. باکتری ها برای ساختن بیوپلیمر های PHA و PHB از واکنش های تخمیری استفاده می کنند که در این واکنش ها نیز ازمواد خام گوناگونی استفاده می شود. PHB به وسیله یک باکتری به نام استافیلوکوکوس اپیدرمیس ساخته می شود که روی تفاله های حاصل از واکنش های روغن گیری دانه های کنجد رشد می کند و این بیوپلیمر را می سازد.
PHB در درون سیتوپلاسم باکتری به صورت دانه های ذخیره ای (اینکلوژن بادی) ذخیره می شود که این مواد را به وسیله سانتریفیوژ و واکنش های شست وشوی چند مرحله ای می توان استخراج و خالص سازی و ازآن استفاده کرد.در یک نتیجه گیری کلی در مورد استفاده از بیوپلیمر ها به جای پلاستیک ها و پلیمر های نفتی می توان گفت که با توجه به ماهیت و خصوصیات بیوپلیمر ها که مواد تجدید شونده و قابل برگشت به محیط زیست و یا به عبارتی دوست محیط زیست هستند، استفاده از آنها کاری معقول و اقتصادی خواهد بود. از سوی دیگر، با توجه به قیمت بالای نفت خام و محدود بودن منابع آن، استفاده از آن برای تولید مواد پلاستیکی که هم آلوده کننده محیط زیست است و هم در جامعه ما ارزش چندانی ندارد، کاری غیر اقتصادی است. پس امید می رود با توجه به سرعت روز افزون علم در زمینه مواد بیوپلیمری در بیشتر کشورها، درکشور ما نیز به این مقوله توجه بیشتری شود و با جانشین کردن مواد بیوپلیمری با پلیمر های نفتی، طلای سیاه را برای آیندگان به میراث بگذاریم.
موضوع : بیوتکنولوژی
شامل روشهایی مانند جداسازی ، خالص سازی ، وارد کردن و تظاهر یک ژن خاص در یک میزبان است که منجر به ایجاد یک صفت جدید یا تولید محصول مورد نظر میشود. مهندسی ژنتیک کابردهای وسیعی دارد.
دید کلی
با استفاده از فنآوری DNA نوترکیب ، مطالعه ساختمان و عملکرد ژن بسیار آسان شده است و جداسازی یک ژن از یک کروموزوم بزرگ نیاز دارد به:
-
روشهایی برای برش و دوختن قطعات DNA
-
وجود ناقلین کوچک DNA که قادر به تکثیر خود بوده و ژنهایی در داخل آنها قرار داده شود.
-
روشهایی برای ارائه ناقل حاوی DNA خارجی به سلولی که در آن بتواند تکثیر یافته و کلنیهایی را ایجاد کند.
-
روشهایی برای شناسایی سلولهای حاوی DNA مورد نظر.
پیشرفتهای حاصل در این فنآوری ، در حال متحول نمودن بسیاری از دیدگاههای پزشکی ، کشاورزی و سایر صنایع میباشد.
پیشرفتهای حاصل از دهها سال کار هزاران دانشمند در زمینههای ژنتیک ، بیوشیمی ، بیولوژی سلول و شیمی فیزیک در آزمایشگاههای متعدد گرد هم آمدند تا فنآوریهایی برای تعیین موقعیت ، جداسازی ، آماده سازی و مطالعه قطعات DNA مشتق از کروموزومهای بسیار بزرگتر را ایجاد نمایند. تاکنون فنآوریهای کلون سازی DNA ، فرصتهای غیر قابل تصوری را برای تعیین هویت و مطالعه ژنهایی فراهم نمودهاند که تقریبا در هر فرآیند بیولوژیک شناخته شده ، نقش دارند. این روشهای جدید ، تحقیقات پایه ، کشاورزی ، پزشکی ، اکولوژی ، پزشکی قانونی و بسیاری از زمینههای دیگر را دگرگون کردهاند.
تخمیرهای میکروبی
تعدادی از محصولات مهم صنعتی بوسیله میکروارگانیزمها ساخته میشوند که از بین آنها ، آنتی بیوتیکها مهمترین گروه میباشند. بوسیله مهندسی ژنتیک میتوان میکروارگانیزمهایی ایجاد کرد که آنتی بیوتیک بیشتری تولید کنند و یا مشتقی از آنتی بیوتیک اولیه را بسازند.
واکسنهای ویروسی
واکسن مادهای است که میتواند سیستم ایمنی را بر علیه یک عامل عفونی تحریک کند. معمولا از ویروسهای کشته شده به عنوان واکسن استفاده میشود، ولی همواره یک خطر احتمالی وجود دارد که ویروس بطور کامل غیر فعال نشده باشد. از آنجایی که معمولا قسمت فعال و ایمنیزایی ویروس ، پروتئینهای پوشش آن هستند، میتوان پروتئینهای پوششی را به تنهایی و بدون قسمتهای دیگر تهیه کرد. برای این کار ژن مربوط به پروتئین پوششی را در یک باکتری و یا در یک ویروس غیر بیماریزا کلون میکنند و از آنها به عنوان واکسنهای بیخطر استفاده مینمایند.
تولید پروتئینهای خاص
تولید پروتئینهای خاص از نظر پزشکی و تجاری ارزش دارد. تولید تجاری پروتئینهای انسان از طریق استخراج از بافتها یا مایعات بدن غیر ممکن یا بسیار گران است. با کلون کردن ژنهای مربوط به این پروتئینها در باکتریها تولید تجاری این پروتئینها ، امکانپذیر میگردد.
حیوانات و گیاهان تغییر یافته
علاوه بر تولید محصولات ارزشمند بوسیله میکروبها ، از مهندسی ژنتیک میتوان به منظور ایجاد گیاهان و جانوران تغییر یافته استفاده کرد. به این گیاهان و جانوران بطور کلی تغییر یافته ژنتیکی (Trasgenetic) ، گفته میشود. تغییرات ژنی این موجودات ، مواردی چون تولید محصولات بیشتر ، تغییر کیفیت گوشت و سبزیجات و تولید پروتئینهای خاص که بوسیله باکتریها ، نمیتوان تولید کرد، را دربر میگیرد. این کار بطور کلی از طریق وارد کردن ژنهای نوترکیب در دوران جنینی به جانوران و در کشت بافت به گیاهان انجام میشود.
بیوتکنولوژی محیط زیست
باکتریها به دلیل تنوع متابولیزمی گسترده ، دارای یک خزانه ژنتیکی بسیار غنی میباشند. در بعضی موارد در این خزانه ژنهایی یافت میشوند که مواد آلوده کننده محیط زیست را تجزیه میکنند. ژنهای تجزیه بیولوژیکی بسیاری از مواد زاید فاضلابهای شهری و پسابهای صنعتی ، از باکتریهای موجود در طبیعت جدا شدهاند. از این ژنها میتوان برای کاهش آلودگیهای محیط زیست استفاده کرد.
مثالی از این کار ، ژنهای تجزیه کننده حشره کشهای کلردار ، مانند 5,4,2- تری کلروفنوکسی استیک اسید ، کلروبنزن ، نفتالین ، تولوئن ، آنیلین و هیدروکربنهای مختلف دیگر میباشد. ژنهای مورد نظر از باکتریهای پسدوموناس ، آلکالیژنس و تعدادی از باکتریهای دیگر جدا شده و در پلاسمیدهای مختلف وارد شده است. همچنین پلاسمیدهایی ایجاد شده است که ژنهای تجزیه کننده چند ماده مختلف را بطور همزمان بر روی خود دارند.
تنظیم ژنها و ژن درمانی
استفاده اولیه مهندسی ژنتیک در تولید محصولات مفید صنعتی و یا بهبود تولید بود، ولی مطالعات اخیر بر روی کنترل ژنهای خاص بنا شده است. امروزه قسمت اعظم تحقیقات پایه در مهندسی ژنتیک بر روی Antisense RNA که نقش مهمی در تنظیم ژنتیکی بیان ژنها به عهده دارد، پایه گذاری شده است. همچنین مطالعات گستردهای بر روی امکان درمان بیماریهای ژنتیکی از طریق وارد کردن ژن سالم یعنی ژن درمانی در حال انجام است.
تولید پروتئینها و هورمونهای کاربردی
یکی از کاربردهای عملی اولیه مهندسی ژنتیک تولید پروتئینهای مورد نظر بوسیله میکروارگانیزمهای سریعالرشد و تولید ارزان قیمت این پروتئینها بود. بسیاری از پروتئینها و پپتیدهای پستانداران ارزش دارویی زیاد دارند، ولی معمولا در مقادیر بسیار ناچیزی در بافتهای طبیعی وجود دارند و استخراج آنها مقرون به صرفه نمیباشد. این پروتئینها را میتوان به راحتی در میکروارگانیزمها تولید کرد.
تولید هورمونها
بسیاری از هورمونها ، پپتیدها و یا پروتئینهای کوچک هستند. این هورمونها در کنترل متابولیزم بدن پستاندارن و مخصوصا انسان استفادههای خاص و مهمی دارند. یکی از مثالهای این تولیدات ، تولید هورمون انسولین میباشد. هورمون انسولین انسانی اولین داروی تولید شده بوسیله مهندسی ژنتیک بود که مصرف عمومی پیدا کرد. انسولین هورمونی است که بوسیله غده لوزوالمعده ترشح میشود و کمبود آن باعث بیماری دیابت میگردد.
بیماری دیابت گریبانگیر میلیونها نفر در سراسر جهان است که روش استاندارد درمان آن ، تزریق منظم انسولین است. چون انسولین پستانداران مختلف تقریبا مشابه میباشد، در ابتدا از انسولین جدا شده از لوزوالمعده گاو و یا خوک استفاده میشد، ولی انسولین غیرانسانی به اندازه انسولین انسانی موثر نیست و هزینه خالص سازی نیز گران میباشد، لکن امروزه این هورمونها توسط مهندسی ژنتیک تولید میشوند.
لازم به ذکر است که تولید هورمونهایی مانند انسولین یک کار ساده مهندسی ژنتیک نیست که فقط شامل وارد کردن ژن مربوطه به داخل حامل و کلون کردن آن باشد، زیرا بسیاری از هورمونها فقط قطعات کوچکی از پلی پپتیدهای بزرگ تولید شده بوسیله ژنها میباشند.
چشم انداز
محصولات فنآوری DNA نوترکیب ، از پروتئینها تا موجودات مهندسی شده متفاوت میباشد. با این فنآوریها میتوان مقادیر زیاد پروتئینها را برای مقاصد تجارتی تولید نمود. از میکروارگانیزمها میتوان برای انجام کارهای اختصاصی استفاده نمود. با استفاده از مهندسی ژنتیک ، میتوان صفاتی را در گیاهان و جانوران ایجاد کرد که برای کشاورزی و پزشکی مفید باشند. بعضی از محصولات این فنآوری برای استفاده مورد تائید قرار گرفته و تعداد زیادی در حال تکامل هستند. در طی چند سال اخیر ، مهندسی ژنتیک از یک فنآوری وعده دهنده به یک صنعت چند بیلیون دلاری تبدیل شده و بیشتر رشد آن در صنعت دارویی بوده است.
| ژنتیک و زیست شناسی مولکولی دو موضوع کاملا مرتبط بهم هستند و اگر چه تفاوتهایی بین آنها موجود است، ولی بهتر است که آنها را در یک قالب مطرح کرد. به این دلیل اصطلاح ژنتیک مولکولی امروزه اغلب برای تشریح شاخهای از زیست شناسی بکار میرود که مربوط به مطالعه همه جنبههای یک ژن است. |
 |
دید کلی
ماهیت مولکولی ماده ژنتیکی چیست؟ چطور اطلاعات ژنتیکی از یک نسل به نسل بعد با صحت بالا انتقال مییابد؟ تغییرات نادر در ماده ژنتیکی که ماده خام تکامل میباشد، چگونه ایجاد میشوند؟ چطور اطلاعات ژنتیکی نهایتا به شکل توالیهای اسید آمینهای مولکولهای پروتئینی متنوع موجود در یک سلول زنده ، بیان میشود؟ و ... . واحد پایه اطلاعات در سیستمهای زنده ، ژن میباشد.
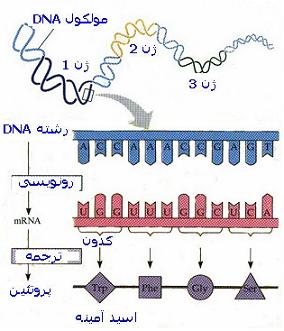
از نظر بیوشیمیایی یک ژن به صورت قطعهای از DNA تعریف میشود که اطلاعات مورد نیاز برای ایجاد یک محصول دارای فعالیت بیولوژیک راکد میکند. محصول نهایی معمولا یک پروتئین است. ممکن است محصول ژنی وظیفهای یکی از انواع RNA باشد. ذخیره ، حفظ و متابولیزم این واحدهای اطلاعاتی موضوعات بحث را در ژنتیک مولکولی تشکیل میدهند. پیشرفتهای اخیر در ژنتیک مولکولی ، منجر به مطرح شدن سه فرآیند اصلی در استفاده از اطلاعات ژنتیکی شده است.
-
اولین فرآیند ، همانند سازی DNA یا نسخه برداری از DNA مادری و تولید مولکولهای DNA با توالیهای نوکلئوتیدی یکسان میباشد.
-
دومین فرآیند سنتز RNA از روی DNA است، که طی قسمتهایی از پیام ژنتیکی کد شده در DNA دقیقا به صورت RNA ، نسخه برداری میشود.
-
سومین فرآیند ، ترجمه میباشد که به موجب آن پیام ژنتیکی کد شده در RNA پیک بر روی ریبوزومها به پلیپپتیدی با توالی مشخص از اسیدهای آمینه ترجمه میشود.
 |
وقایع مهم در ژنتیک مولکولی تا سال 1944
-
شروع ژنتیک توسط گرگور مندل و با مقالهای بود که وی در سال 1866 در مجموعه مقالات انجمن علوم طبیعی در مورد نخود فرنگی ، به چاپ رساند.
-
تا سال 1900 طول کشید تا سایر زیست شناسان مانند هوگو ، کورنس و شرماک اهمیت کار مندل را درک کنند و این علم پس از رکورد طولانی توالی دوباره یافت.
-
در سال 1903 ، ساتن پیشنهاد کرد که ژنها روی کروموزومها قرار دارند.
-
در سال 1909 ، یوهانس پیشنهاد کرد که عوامل مندلی ژن نامیده شدند.
-
در سال 1910 ، مورگان آزمایشهای زیادی بر روی مگس سرکه انجام داد.
-
در سال 1927 ، مولر کشف کرد که اشعه ایکس ایجاد موتاسیون (جهش) در مگس سرکه مینماید.
-
در سال 1944 ، کتاب زندگی چیست توسط یک فیزیکدان به نام شرودینگر انتشار یافت.
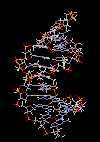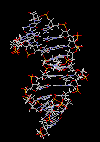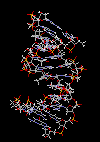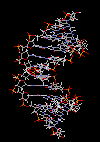
کشف ساختمان DNA
شناخت امروزی ما در مورد مسیرهای اطلاعاتی از همگرایی یافتههای ژنتیکی ، فیزیکی و شیمیایی در بیوشیمی امروزی حاصل شده است. لین شناخت در کشف ساختمان دو رشته مارپیچی DNA ، توسط جیمز واتسون و فرانسیس کریک در سال 1953 خلاصه گردید. فرضیه ژنتیکی ، مفهوم کد نمودن توسط ژنها را مشخص نمود. با استفاده از روشهای فیزیکی ، تعیین ساختمان مولکولی DNA بوسیله آزمایش انکسار اشعه ایکس ممکن گردید. شیمی نیز ترکیب DNA را آشکار نمود. ساختمان مارپیچی دو رشتهای DNA ، چگونگی نسخه برداری آن را نشان داد، نحوه تولید RNA و سنتز پروتئین از روی آن را شفاف کرد.
 |
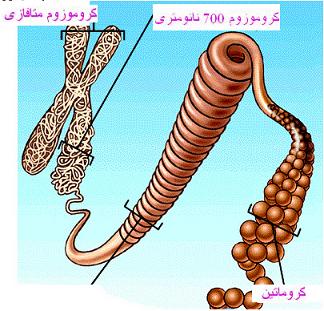
ژنها و کروموزومها
ژنها قطعاتی از یک کروموزوم هستند که اطلاعات مورد نیاز برای یک مولکول DNA یا یک پلی پپتید را دارند. علاوه بر ژنها ، انواع مختلفی از توالیهای مختلف تنظیمی در روی کروموزومها وجود دارد که در همانند سازی ، رونویسی و ... شرکت دارند. کروموزومهای یوکاریوتی دارای دو توالی مهم تکراری DNA میباشند که عمل اختصاصی را انجام میدهند؛ سانترومرها که نقاط اتصالی برای دوک تقسیم هستند و تلومرها که در دو انتهای کروموزوم وجود دارند. کروماتین در یوکاریوتها به صورت واحدهای نوکلئوزومی قرار دارد.
متابولیزم DNA
سلامت DNA بیشترین اهمیت را برای سلول دارد که آن را میتوان از پیچیدگی و کثرت سیستمهای آنزیمی شرکت کننده در همانند سازی ، ترمیم و نوترکیبی DNA ، دریافت. همانند سازی DNA با صحت بسیار بالا و در یک دوره زمانی مشخص در طی چرخه سلولی به انجام می رسد. همانند سازی نیمه حفاظتی است، بطوری که هر رشته آن به عنوان قالبی برای تولید رشته جدید DNA مورد استفاده قرار میگیرد. سلولها دارای سیستمهای متعددی برای ترمیم DNA هستند. توالیهای DNA در طی واکنشهای نوترکیبی ، در فرآیندهایی که شدیدا هماهنگ با همانند سازی یا ترمیم DNA هستند، نو آرایی میشوند.
متابولیزم RNA
رونویسی توسط آنزیم RNA پلیمراز وابسته به DNA کاتالیز میشود. رونویسی در چندین فاز ، شامل اتصال RNA پلیمراز به یک جایگاه DNA به نام پروموتور ، شروع سنتز رونویسی ، طویل سازی و خاتمه ، روی میدهد. سه نوع RNA ساخته میشود؛ RNA پیک که برای ساختن پلی پپتیدها مورد استفاده قرار میگیرد. RNA ناقل که در انتقال اسیدهای آمینه بر روی ریبوزومها برای پروتئین سازی ، شرکت دارند و RNA ریبوزومی که در ساختار ریبوزوم شرکت دارند. این RNA ها به صورت پیش ساز ساخته میشوند که طی فرآیندهای آنزیمی بالغ میشوند.
متابولیزم پروتئین
پروتئینها در یک کمپلکس RNA پروتئینی به نام ریبوزوم ، با یک توالی اسید آمینههای خاص در طی ترجمه اطلاعات کد شده در RNA پیک ، سنتز میگردند. اسیدهای آمینهای که توسط کدونهای RNA پیک مشخص میگردند، از کلمات سه حرفی نوکلئوتیدی تشکیل شدهاند. برای ترجمه نیاز به مولکولهای RNA ناقل میباشد که با شناسایی کدونها ، اسیدهای آمینه را در موقعیتهای متوالی مناسب خود در داخل زنجیر پلی پپتیدی قرار میدهند. بعد از سنتز بسیاری از پروتئینها به موقعیتهای خاص خود در داخل سلول هدایت میشوند.
 |
تنظیم بیان ژن
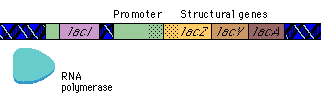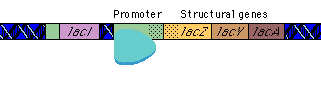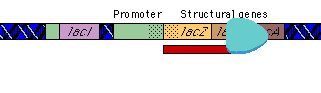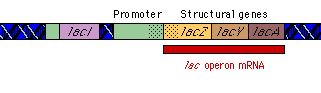
بیان ژنها توسط فرآیندهایی تنظیم میشود که بر روی سرعت تولید و تخریب محصولات ژنی اثر میگذارند. بیشتر این تنظیم در سطح شروع رونویسی و بواسطه پروتئینهای تنظیمی رخ میدهد که رونویسی را از پروموتورهای اختصاصی مهار یا تحریک میکنند. اثر مهارکننده ها را تنظیم منفی و فعال شدن را تنظیم مثبت گویند. پروتئینهای تنظیمی ، پروتئینهای اتصالی DNA هستند که توالیهای اختصاصی از DNA را شناسایی میکنند. هورمونها بر روی تنظیم بیان ژن تأثیر دارند. موجودات یوکاریوت و پروکاریوت دارای مکانیزمهای متفاوتی برای تنظیم بیان ژنهای خود دارند.
فناوری DNA نوترکیبی
با استفاده از فناوری DNA نو ترکیبی مطالعه ساختمان و عملکرد ژن بسیار آسان شده است. جداسازی یک ژن از یک کروموزوم بزرگ نیاز دارد به، روشهایی برای برش و دوختن قطعات DNA ، وجود ناقلین کوچک که قادر به تکثیر خود بوده و ژنها در داخل آنها قرار داده میشوند، روشهایی برای ارائه ناقل حاوی DNA خارجی به سلولی که در آن بتواند تکثیر یافته و کلنیهایی را ایجاد کند و روشهایی برای شناسایی سلولهای حاوی DNA مورد نظر. پیشرفتهای حاصل در این فناوری ، در حال متحول نمودن بسیاری از دیدگاههای پزشکی ، کشاورزی و سایر صنایع میباشد.
|
مهندسی ژنتیک ، شامل تکنیکهایی مانند جداسازی ، خالص سازی ، وارد کردن و تظاهر یک ژن خاص در یک میزبان میباشد که نهایتا منجر به بروز یک صفت خاص و یا یک محصول مورد نظر میشود. |
دید کلی
کاربردهای مهندسی ژنتیک تقریبا نامحدود به نظر میرسد. این علم کاربردهای زیادی در علوم پایه و همچنین تولیدات صنعتی ، کشاورزی و علوم پزشکی دارد. در زمینه علوم پایه ، بررسیهایی مانند مکانیزمهای همانند سازی DNA و بیان ژنها در پروکاریوتها ، یوکاریوتها و ویروسها و همچنین چگونگی ساخته شدن و تغییرات پروتئینهای داخلی سلول و همچنین مکانیزم ایجاد سرطان از جمله کاربردهای مهندسی ژنتیک است. در زمینه کشاورزی که زمینه بسیاری از کاربردهای مهندسی ژنتیک بوده است، تولید گیاهان مقاوم به آفات گیاهی و خشکی ، تولید گیاهان پرمحصول و تولید گاوهای دارای شیر و گوشت بیشتر ، را میتوان نام برد. در زمینه کاربردهای انسانی ، تشخیص بیماریهای ارثی ، تولید انسولین انسانی ، تولید هورمون رشد انسان و ... را میتوان نام برد. |
تاریخچه
اهمیت بعضی از اصول علمی ، در زمان کشف آنها مشخص نمیشود، بلکه پس از مدت زمانی که میگذرد ارزش آنها معلوم میشود. یکی از مثالهای روشن این مساله کشف ساختمان سه بعدی DNA بوسیله واتسون و کریک در سال 1953 بود. این ساختمان نسبتا ساده باعث شد تا دانشمندان سیستمهای مختلف ژنتیکی را بررسی کنند. اما مطلب به همین جا ، ختم نشد و دانشمندان مختلف سعی کردند که از این اطلاعات استفاده نمایند. هدف آنها نیز بیان سادهای داشت. آنها خواستند تا یک DNA را از یک موجود بگیرند و در موجود دیگر وارد نمایند تا اثرات آن ژن در موجود ثانویه بروز کند.این علم نوین که به تدریج جای خود را در بین علوم دیگر پیدا کرد، با عناوین چون زیست مولکولی ، مهندسی ژنتیک و نهایتا DNA نوترکیب (Recombinant DNA) نامیده میشود. مثالی معروف از کارهای مهندسی ژنتیک تولید یک نوع باکتری اشرشیاکلی (E.Coli) است که قادر است انسولین انسانی بسازد. یا تولید گیاهان مقاوم به شوری و خشکی.
مراحل مهندسی ژنتیک
- انتخاب ژن مورد نظر
- جداسازی ژن مورد نظر
- وارد کردن ژن مورد نظر در حامل
- تکثیر ژن در میزبان مناسب
- انتقال حامل ژن به سلول هدف
- تکثیر سلول هدف
- تولید انبوه محصول یا ایجاد صفت مورد نظر
تولید DNA نوترکیب با استفاده از آنزیمهای محدودالاثر(Restriction)
- گروهی از آنزیم های محدودالاثر هنگام برش ، توالیهای مورد شناساییشان را بطور نامتقارن میشکنند، در نتیجه در انتهای قطعات DNA حاصله رشتههای تکی با حدود 4 نوکلئوتید بوجود میآید که به این انتهای تک رشتهای ، انتهای چسبنده (Sticky end) میگویند. یکی از آنزیمها ECORI نام دارد که باعث ایجاد قطعاتی میشود که در انتهای خود ، چسبنده میباشند.
- حال فرض کنید که دو قطعه متفاوت DNA بوسیله یک آنزیم محدودالاثر یکسانی برش داده شدهاند، اگر قطعات حاصل از این برش با هم مخلوط شوند و شرایط مناسب فراهم شود انتهاهای چسبناک که مکمل هم میباشند بهم متصل میشوند. سپس بوسیله آنزیم DNA لیگاز این رشتهها به صورت کووالانسی بهم متصل میشوند.
- هدف اصلی برش DNA در مهندسی ژنتیک ، اتصال دو قطعه DNA به یکدیگر میباشد. ولی هنگام اتصال قطعات DNA ممکن است بجای اینکه قطعات DNA بهم متصل شوند، دو سر یک مولکول DNA بار دیگر بهم بچسبند و در نتیجه نوترکیب صورت نگیرد. برای جلوگیری از این کار از آنزیم فسفاتاز قلیایی استفاده میکنند. به این صورت که پس از برش دادن حامل بوسیله آنزیم محدودالاثر فسفاتاز را به محیط واکنش میافزایند و در نتیجه فسفات انتهای 5 مولکول DNA در هر دو طرف جدا میشود و امکان اتصال دو سر مولکول حامل ، بدون DNA تازه ، به یکدیگر از بین میرود.
سیستمهای کلون کردن ژن
کلون کردن یک ژن خاص مهمترین مرحله مهندسی ژنتیک است. هدف از کلون کردن ژن به دست آوردن مقادیر زیادی از ژنهای خاص به صورت خالص میباشد. هدف اصلی کلون کردن ژن ، انتقال ژن مورد نظر از داخل یک ژنوم بزرگ و پیچیده به داخل یک حامل ساده و کوچک تکثیر آن است.مراحل کلون کردن ژن
- جداسازی و قطعه قطعه کردن منبع DNA: منبع DNA میتواند، ژنوم کامل یک موجود باشد که در این صورت، باید آن را بوسیله آنزیم محدودالاثر برش داد و قطعات حاصله را برای کلون کردن بکار برد.
- اتصال به یک حامل کلون (Cloning Vector): حاملهای کلون ، قطعات ژنتیکی کوچکی هستند که بطور مستقل توانایی تکثیر دارند و دارای محل برش بوسیله آنزیمهای محدودالاثر میباشند، ولی این برش نباید در محل همانند سازی این حاملها باشد.
- ورود به داخل میزبان:DNA نوترکیب حاصل به روشهای مختلف وارد باکتری یا میزبان مورد نظر میشود.
- شناسایی و جداسازی کلون حاوی ژن مورد نظر: این مرحله شامل جداسازی میزبانهایی است که ژن مورد نظر بوسیله حامل وارد آنها شده و به نحو موثر بیان میشود.
- تولید تعداد زیاد سلولها و یا باکتریهای حاوی ژن: این کار به منظور جداسازی و بررسی ژن مورد نظر ، انجام میگیرد.
حاملهای کلون (Cloning Vector)
پلاسمیدها
قطعات DNA حلقوی هستند. که در داخل سیتوپلاسم باکتریها و جدا از کروموزوم آنها قرار دارند و بطور مستقل تکثیر میشوند. پلاسمیدها ، خصوصیات مفیدی برای استفاده به عنوان حامل دارند مانند: اندازه کوچک ، DNA حلقوی ، همانند سازی مستقل ، تکثیر زیاد و شاخصهای مفید دیگر مانند دارا بودن ژنهای مقاومت به آنتی بیوتیک که جداسازی کلنیهای حاوی پلاسمید را راحتتر میکند.باکتریوفاژها (ویروس باکتری)
- ویروسها به خاطر داشتن پروتئینهای خاص ، نفوذ بسیار موثر و اختصاصی را به داخل سلولهای میزبان انجام میدهند.
- بعضی ویروسها در قسمتی از چرخه تکثیر خود ، نفوذ پایداری به داخل ژنوم میزبان دارند که این باعث پایداری بیان ژن در داخل سلول میزبان میشود.
- ویروسها دارای پروموتورهای خاصی هستند که بوسیله سلولهای میزبانی شناخته میشوند و این باعث بیان مناسب ژنهای کلون شده میشود.
کازمیدها (Cosmids)
کازمیدها در حقیقت قطعات حاصل از دو انتهای ژنوم از دو انتهای ژنوم باکتریوفاژها لامبدا قرار بگیرند و در نتیجه وارد سلول Ecoli (باکتری اشرشیاکلی)شوند. در داخل سلول E.Coli این DNA به صورت حلقوی در آمده و مانند یک پلاسمید عمل می کند.فاسمیدها
یکی دیگر از حاملهای DNA نوترکیب هستند که ترکیبی از ژنوم باکتریوفاژ و پلاسمیدها هستند.انتخاب میزبان مناسب
میزبان مورد نظر باید خصوصیاتی از قبیل پایداری ژنتیکی ، ژنوم کاملا شناخته شده مشخصات فیزیولوژیک معلوم ، توانایی پذیرش DNA خارجی ، داشتن یک شاخص خاص برای شناسایی در مواقع لزوم و ... را داشته باشد. یکی از شناخته شده ترین میزبانهای مورد استفاده باکتری E.Coli است. هنگام انجام کارهای ژنتیکی باید با مطالعاتی کافی یک سیستم حامل میزبان مناسب را انتخاب کرد و بکار برد. باسیلوس سوبتلیس (B.Subtilis) در مواردی که هدف از کلون کردن تولید یک پروتئین خالص میباشد، بر E.Coli ترجیح دارد. زیرا خصوصیات تخمیری این باکتری برای تولیدات صنعتی مناسب تر است.روشهای وارد کردن حاملها به داخل میزبان
ویروسها و باکتریوفاژها
برای ویروسها و باکتریوفاژها و همچنین DNA نوترکیب که در داخل کپسید ویروس ها قرار گرفتهاند (کاسمیدها) روش ورود واضح است و همانند ورود معمولی ویروس ها در سلول های میزبان است.- ترانسفورماسیون: برای این کار DNA نوترکیب را با باکتری مجاور میکنند. این روش یکی از متداولترین روشهای انتقال است.
- الکتروپوریشن: در این روش قطعات DNA را در یک محیط دارای بار الکتریکی در مجاورت سلولها قرار میدهند. بار الکتریکی باعث ایجاد منافذ ریز در غشای سیتوپلاسمی میشود که این خود باعث تسهیل ورود قطعات DNA به داخل سلول میگردد.
- تفنگ ذرهای یا تفنگ اسید نوکلئیک: در این روش دقیقا تنگی در مقیاس میکروسکوپی وجود دارد که گلوله آن قطعات DNA میباشد و DNA را به داخل سلول ، شلیک میکند.
انتخاب کلونهای تغییر یافته
پس از اینکه DNA نوترکیب ساخته شد و در داخل باکتری میزبان ، انتقال داده شد. حال نوبت به انتخاب کلونهای باکتریایی میرسد که DNA نوترکیب مورد نظر به داخل آن انتقال یافته و به نحو موثری در داخل آن بیان شود. 3 خصوصیت در بین حاملین مشترک است. قدرت تکثیر در میزبان ، محل ورود ژن خارجی و یک شاخص انتخابی.شاخصهای انتخابی موجود بر روی حاملها
مقاومت به آنتی بیوتیکها
مقاومت به آنتی بیوتیکها معمولا یا بوسیله آنزیم هایی ایجاد میشود که باعث غیر فعال شدن آنتی بیوتیکها میشوند و یا با سنتز پروتئینهایی است که به روشهای مختلف باعث ممانعت از اثر آنتی بیوتیکها میشوند. هر دو نوع مکانیزم مقاومت فوق بوسیله قطعات ژنتیکی ، کنترل میشوند. این قطعات ژنتیکی را میتوان در حاملها وارد کرد و از آنها به عنوان شاخصهای انتقال موثر استفاده کرد.نیازهای متابولیزمی
نیازهای متابولیزمی طیف وسیعی از مواد مختلف را شامل میشود. برای این کار از گونههای خاص از میزبان استفاده میشود که تونایی ساختن یک ماده متابولیزمی ضروری از دست دادهاند، در نتیجه این باکتریها بر روی محیطهای بدون این ماده متابولیزمی رشد ، نخواهد کرد. برای مثال اگر یک باکتری توانایی تولید اسید امینه لوسین را نداشته باشد. بر روی محیط فاقد لوسین رشد نخواهد کرد.حال اگر ما از حاملی استفاده کنیم که حاوی ژن سنتز لوسین باشد، باکتریهای میزبان حاوی این حاملها بر روی محیط فاقد لوسین رشد خواهند کرد. پس از اینکه کلنیهای حاوی ژن نوترکیب انتخاب و جدا شدند، این کلنیها را به میزان دلخواه تکثیر میدهند و سپس ژن تکثیر شده را برای بررسیهای بعدی استخراج کرده قرار میدهند.
حاملهای بیان ژن (Expression Vector)
یک حامل بیان ژن حاصل است که نه تنها میتوان از آن به عنوان حامل کلون استفاده کرد. بلکه این حامل دارای کی توالی تنظیمی میباشد که باعث میشود که بیان ژن مورد نظر تحت کنترل مهندسی ژنتیک قرار گیرد. یک حامل بیان ژن خوب باید دارای مشخصات زیرا باشد. هر چه قدر تعداد نسخههای یک ژن بیشتر باشد، میزان بیان آنها بیشتر خواهد بود. پلاسمیدها از این نظر مناسب هستند. قدرت آغازگری آن خوب باشد. الگوی خواندن آن مناسب باشد. بطور کلی وظیفه مهندسی ژنتیک ایجاد یک حامل مناسب است که بتوانند بطور موثری به داخل میزبان وارد شود به تعداد همانند سازی کند بطور موثر نسخه برداری شود - بطور موثر ترجمه شود.
| رمز ژنتیکی تعداد نوکلئوتیدهایی است که برای ساختن یک اسید آمینه لازم است. برای تعیین تعداد این نوکلئوتیدها آزمایشهای زیادی صورت گرفت و مشخص شد که تعداد نوکلئوتیدها برای ساختن یک اسید آمینه 3 عدد میباشد. |
دید کلی
از سال 1953 که ساختار مولکولی DNA به صورت مارپیچ مضاعف مطرح شد و DNA به عنوان مرکز اطلاعات یاخته و نیز واسطه انتقال اطلاعات از نسلی به نسل دیگر یاختهای مورد تاکید قرار گرفت. مساله اصلی چگونگی دخالت این مولکول در عملکردهای یاختهای بود. از همان زمان این نظر قوت گرفت که سنتز پروتئینها مثل دیگر فرآیندهای زیستی یاختهها تحت کنترل ماده ژنتیکی باشد.پیشرفتهای حاصل نشان داد که عمل پروتئین سازی در واقع نوعی ترجمه است که طی آن زبان اطلاعاتی DNA و RNA به زبان اسیدهای آمینه تبدیل میشود. توالی اسیدهای آمینه بوسیله RNA پیک (mRNA) تعیین میشود و به عبارت دیگر رمز مربوط به اسیدهای آمینه بر روی mRNA قرار دارد. اما مشخص کردن این امر دشوار و حتی غیر ممکن بنظر میرسید زیرا هیچ روشی برای ایجاد ارتباط مستقیم بین رمز اسیدهای آمینه و mRNA وجود نداشت.
سیر تحولی
- در اوایل دهه 1950 پائول زامک نیک آزمایشاتی را برای تعیین محل سنتز پروتئین در داخل سلول انجام داد و تعیین کرد که سنتز پروتئین در اندامکهایی به نام ریبوزوم صورت میگیرد.
- دومین پیشرفت کلیدی توسط مالون هاگلند بدست آمد که نشان داد اسیدهای آمینه برای شرکت در پروتئین سازی در ریبوزومها ، باید به RNA محلول که بعدها RNA ناقل نامیده شد، متصل شوند.
- سومین پیشرفت کلیدی زمانی حاصل شد که کریک نحوه کد شدن اطلاعات ژنتیکی در زبان 4 حرفی نوکلئوتیدها به زبان 20 حرفی پروتئینها را مورد بررسی قرار داد. لازم به یادآوری است که فقط 20 اسید آمینه در ساختار پروتئینها شرکت دارند.این سه پیشرفت بزودی منجر به شناسایی مراحل اصلی سنتز پروتئین و نهایتا رمز گشایی ماده ژنتیکی گردید که هر اسید آمینه را مشخص میکند.
رمز ژنتیکی (Genetic Code)
در بین RNA های مختلف فقط RNA پیک حاوی رمز ژنتیکی برای سنتز پروتئینها میباشد. بازهای سازنده RNA پیک فقط 4 نوع هستند در حالی که پروتئینها از 20 نوع اسید آمینه ساخته شدهاند. بنابراین باید بین بازهای موجود در مولکول RNA پیک و اسیدهای آمینه رابطهای وجود داشته باشد تا بتوان رمز 4 حرفی RNA پیک را به رمز 20 حرفی پروتئینها ترجمه کرد. اگر یک نوکلئوتید نماینده یک اسید آمینه فرض شود در این صورت فقط رمز ترجمه چهار اسید آمینه بدست میآید (41).اگر دو نوکلئوتید برای یک اسید آمینه در نظر گرفته شود در این صورت رمز ترجمه 16 (42) اسید آمینه بدست می آید که البته با مقایسه 20 اسید آمینه کافی نیست. اگر 3 نوکلئوتید را رمز ترجمه یک اسید آمینه فرض کنیم در این صورت 64 (43) رمز برای 20 اسیدآمینه بدست می آید. رمز سه نوکلئوتیدی ، رمز بازهای سه گانه (Triplet) نامیده می شود. RNA حامل ، واسط بین اسیدهای آمینه و بازهای سه گانه RNA پیک در پروتئین سازی است.
آزمایش نیرنبرگ برای تعیین رمز اسید آمینه
برای این که بتوان مکانیسم بیوسنتز پروتئینها را مطالعه کرد. نخست باید مخلوط مناسبی از مواد مختلف داخل سلولی تهیه نمود و با افزایش اسیدهای آمینه رادیواکتیو در این محیط واکنشهای سنتز پروتئینها را روشن ساخت. نیرنبرگ 20 نمونه از این مخلوط تهیه کرد و به هر یک از این نمونهها مقداری پلیمر اسید اوریدیلیک و تنها یکی از 20 اسید آمینه را به صورت رادیواکتیو افزوده و نمونهها را در دمای 37 درجه سانتیگراد قرار داد، رسوب حاصل فقط حاوی اسید آمینه فنیل آلانین است. بنابراین رمز فنیل آلانین در پلی u وجود دارد و باز سه گانه مربوطه uuu است. نیرنبرگ با تکرار آزمایش و انتخاب پلیمرهای مصنوعی دیگر ، بازهای سه گانه ccc را برای رمز پرولین و AAA را برای لیزین تعیین کرد.روش شیمیایی شناسایی رمزهای سه گانه
نیرنبرگ و یکی از همکاران او به نام لدر با استفاده از روشهای شیمیایی ترینوکلئوتیدهای مختلفی را که ردیف بازهای آنها کاملا معلوم بود تهیه نموده و آنها را به جای پلینوکلئوتیدهای مصنوعی در تجربه فوق مورد استفاده قرار دادند. به کمک این تجربیات دانشمندان فوق به این نتیجه رسیدند که هر باز سه گانه بر روی ریبوزوم قرار گرفته و با یک RNA ناقل که حامل اسیدهای آمینه مربوط به این باز سه گانه است پیوند مییابد. این ترکیب را میتوان با روش صاف کردن روی نیترات سلولز ، به صورت خالص جدا ساخته و اسید آمینه و باز سه گانه موجود در آن را تعیین کرد و رمز مربوطه را شناخت.رابطه رمز ژنتیکی با سنتز پروتئینها
از 64 باز سه گانه یا کدون سه کدون به کدونهای بیمعنی (Nonsense) معروف هستند، فاقد هر گونه رمز برای اسیدهای آمینه هستند اما دست کم دو تا از آنها حاوی علایم پایانی سنتز پروتئینی میباشند به این معنی که نقطه پایان پلیمر شدن اسیدهای آمینه به صورت پروتئین را تعیین میکنند. 61 کدون باقیمانده حاوی رمزهایی برای انتخاب 20 اسید آمینه هستند و این خود به این معنی است که در رمزهای ژنتیکی بعضی از رمزها تکراری هستند یعنی چند کدون حاوی رمز یک اسید آمینه واحد میباشند.ویژگیهای عمومی رمزهای ژنتیکی
- رمزهای ژنتیکی گسسته نیستند. یعنی بین آخرین نوکلئوتید یک رمز و اولین نوکلئوتید رمز بعدی فاصلهای وجود ندارد به عبارت دیگر بین دو رمز ژنتیکی ، نوکلئوتیدی بدون رمز وجود ندارند.
- رمزهای ژنتیکی منحصر به فرد و در عین حال مترادف هستند. به این معنی که از یک سو یک رمز ژنتیکی برای اسید آمینهای هم در پروکاریوتها و هم در یوکاریوتها رمزی برای همین اسید آمینه است و به جز متیونین و تریپتوفان هر اسید آمینه بیش از یک رمز دارد (رمزهای مختلف).
- در بین ترادفهای هر رمز ژنتیکی ، تفاوت بطور معمول مربوط به نوکلئوتید سوم است. کمتر اختصاصی بودن باز سوم ، عاملی برای سهولت باز شدن پیوند بین رمز و ضد رمز هنگام سنتز پروتئین است. پدیده تغییر پذیری باز سوم ، انعطاف پذیری نام دارد. پدیده انعطاف پذیری یا لرزش موجب میشود برخی جهشهای ژنی که منجر به تغییر در سومین باز رمز میشوند، اثر نامناسبی در سنتز پروتئین بر جای نگذارند.
منبع: دانشنامه رشد
| مهمترین گروه از پروتئینها هستند که انجام واکنشهای بیوشیمیایی و سرعت بخشیدن به آنها را بر عهده دارند و به همین دلیل این ترکیبات کاتالیزگرهای زیستی نامیده میشوند که به عنوان کاتالیزگرهای یاختهای نیز معروفند. |
مقدمه
آنزیمها ترکیباتی هستند که میتوانند سرعت واکنش را تا حدود 107 برابر افزایش دهند. آنزیم مانند یک کاتالیزگر غیر آلی میزان واکنش را با پایین آوردن انرژی فعال سازی واکنش لازم برای انجام واکنش تسریع میکند و برخلاف آن انرژی فعال سازی را با جایرگزین کردن یک سد انرژی فعال سازی بزرگ با یک سد انرژی سازی کوچک پایین میآورد. انجام سریع یک واکنش در موقعیت آزمایشگاهی به شرایط ویژهای مانند دما و فشار بالا نیاز دارد. لذا باید در یاخته که شرایط محیطی در آن کاملا ثابت است و انجام چنین واکنشهایی بسیار کند است، مکانیسمی دقیق وجود داشته باشد. این عمل بوسیله آنزیمها صورت میگیرد.کاتالیزورها در واکنشها بدون تغییر میمانند، ولی آنزیمها مانند سایر پروتئینها تحت شرایط مختلف پایدار نمیمانند. این مواد در اثر حرارت بالا و اسیدها و قلیاها تغییر میکنند. کاتالیزورها تاثیری در تعادل واکنش برگشت پذیر ندارند، بلکه فقط سرعت واکنش را زدیاد میکنند تا به تعادل برسند. آنزیمها با کاهش انرژی فعال سازی (activation) سرعت واکنش شیمیایی را افزایش میدهند.
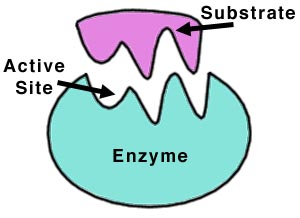
آنزیمها مولکولهای پروتئینی هستند که دارای یک یا چند محل نفوذ سطحی (جایگاههای فعال) هستند که سوبسترا یعنی مادهای که آنزیم بر آن اثر میکند، به این نواحی متصل میشود. تحت تاثیر آنزیمها ، سوبسترا تغییر میکند و به یک یا تعدادی محصول تبدیل میشود.
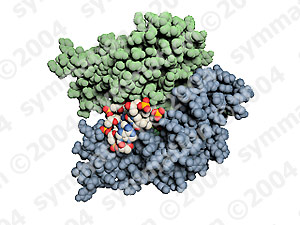 |
تاریخچه
کشف آنزیمها در واقع به پژوهشهای وسیع پاپن و پرسوز وابسته بود. آنان در سال 1833 موفق شدند از جو سبز شده ترکیبی را به نام مالت کشف کنند که نشاسته را به قند مبدل میساخت و این ترکیب را دیاستاز نامیدند که امروزه به نام آنزیم آمیلاز معروف است. چند سال بعد شوان برای نخستین بار آنزیم پپسین را که موجب گوارش گوشت میشد، کشف کرد و همین طور ادامه پیدا کرد اما وکونه نخستین کسی بود که آنزیم را بجای دیاستاز بکار برد.سیر تحولی و رشد
- بیشتر تاریخ بیوشیمی ، تاریخ تحقیق آنزیمی است. کاتالیز بیولوژیکی برای اولین بار در اواخر قرن 18 طی مطالعات انجام شده بر روی هضم گوشت توسط ترشحات معده انجام شد. بعد بوسیله تبدیل نشاسته به قندهای ساده توسط بزاق ادامه یافت. « لویی پاستور » گفت که تخمیر قند به الکل توسط مخمر بوسیله خمیر مایه کاتالیز میشود.
- بعد از پاستور ، « ادوارد بوخنر » ثابت کرد که تخمیر توسط مولکولهایی تسریع میگردد که بعد از جدا شدن از سلولها ، همچنان فعالیت خود را ادامه میدهند. « فردریک کوهن » این مولکولها را "آنزیم" نامید.
- جداسازی و کریستالیزه کردن آنزیم « اوره آز » در سال 1926 توسط « جیمز سامند » منجر به رفع موانع در مطالعات اولیه آنزیم شناسی گردید.
ساختار آنزیمها
آنزیمها ماهیتی پروتئینی دارند و ساختار بعضی ساده یعنی از یک زنجیره پلی پپتیدی ساخته شدهاند و بعضی الیگومر هستند. ساختار بعضی از آنزیمها منحصرا از واحدهای اسید آمینه تشکیل یافته اما برخی دیگر برای فعالیت خود نیاز به ترکیبات غیر پروتئینی دارند که به نام گروه پروستتیک معروف است و این گروه میتواند یک فلز یا یک کو آنزیم باشد و با آنزیم اتصال محکمی را برقرار میکنند. بخش پروتئینی آنزیم (بدون گروه پروستتیک) آپوآنزیم نام دارد و مجموع آنزیم فعال از نظر کاتالیزوری و کوفاکتور مربوطه هولوآنزیم نام دارد.طبقه بندی آنزیمها
آنزیمها را از نظر فعالیت کاتالیزی به شش گروه اصلی تقسیم میکنند.- اکسید و ردوکتازها :
واکنشهای اکسید و احیا (اکسایش – کاهش) را کاتالیز میکند (دهیدروژناز).
- ترانسفرازها : انتقال عوامل ویژهای مانند آمین ، فسفات و غیره را از مولکولی به مولکول دیگر به عهده دارند و مانند آمینو ترانسفرازها که در انتقال گروه آمین فعال هستند.
- هیدرولازها : واکنشهای آبکانتی را کاتالیز میکنند. مانند پپتیدازها که موجب شکسته شدن پیوند پپتیدی میشوند.
- لیازها : موجب برداشت گروه ویژهای از مولکول میشوند. مانند دکربوکسیلازها که برداشت دیاکسید کربن را برعهده دارند.
- ایزومرازها : واکنشهای تشکیل ایزومری را کاتالیز میکنند. مانند راسه ماز که از L- آلانین ترکیب ایزومریD- آلانین را میسازد.
- لیگازها : آنزیمهایی هستند که باعث اتصال دو مولکول به یکدیگر و ایجاد پیوند کووالانسی بین آنها میشوند. مانند استیل کوآنزیم A سنتتاز که موجب سنتز استیل کوآنزیم A میگردد.
 |
طرز کار آنزیمها
از ویژگیهای مهم آنزیمها این است که پس از انجام هر واکنش و در پایان آن سالم و دست نخورده باقی میمانند و میتوانند واکنش بعدی را کاتالیز کنند. در یک واکنش ساده ابتدا آنزیم (E) با ماده اولیه یا سوبسترا (S) ترکیب میشود و کمپلکس آنزیم – سوبسترا میدهد در مرحله بعدی با انجام واکنش ، فراورده یا محصول (P) ایجاد میشود و آنزیم رها میگردد.هر آنزیم بر سوبسترای ویژه خود اثر کرده و فرآورده ویژهای را تولید میکند. به این منظور هر آنزیم ساختار سه بعدی ویژه خود را دارا است که آن را برای انجام فعالیت کاتالیزی مناسب میسازد و بخشی از آنزیم که با سوبسترا بند و بست مییابد، جایگاه فعال نام دارد و در مورد اتصال آنزیم به سوبسترا الگوهایی ارائه شدهاند که مدل کوشلند که الگوی القایی نام دارد و حالت دست در دستکش را دارد، نشان میدهد. بطوری که محل اتصال حالت انعطاف پذیری دارد.
عوامل بازدارنده
بعضی از ترکیبات میتوانند با آنزیم – سوبسترا ترکیب و فعالیت سوبسترا ایجاد فرآورده اختصاصی سوبسترای آن را تحت تاثیر قرار دهند و در صورتیکه این ترکیبات موجب تشکیل نشدن فراورده شوند، به نام بازدارندههای آنزیمی نامیده میشوند که به سه نوع زیر موجودند.- بازدارندههای رقابتی.
- بازدارندههای نارقابتی.
- بازدارندههای بیرقابتی.
پروآنزیم یا زیموژن
برخی از آنزیمها ، ابتدا به صورت پروآنزیم یا زیموژن یا آنزیم غیر فعال در سلول ساخته میشوند و برای شرکت در واکنش و پدیدار شدن خاصیت کاتالیزوری آنها ، باید بوسیله ماده دیگر به صورت فعال درآیند.عمل متقابل آنزیم و سوبسترا
اگر چه میتوان آنزیم و سوبسترا را همانند قفل و کلید تصور کرد، اما این بدان معنی نیست که جایگاه فعال آنزیم ساختمانی سفت و غیر قابل انعطاف است. در بعضی از آنزیمها ، جایگاه فعال فقط بعد از اینکه ماده زمینه به آن متصل شد، دقیقا مکمل سوبسترا میشود. این پدیده تناسب القایی نام دارد.عمل اختصاصی آنزیمها
برخلاف کاتالیزورهای غیر آلی ، فعالیت آنزیم اختصاصی است، یعنی هر آنزیم میتواند بر سوبسترای مشخص اثر کند. در عین حال درجات مختلفی از تخصص وجود دارد. علت اختصاصی بودن آنزیمها را باید در ساختار فضایی آن جستجو کرد. بعضی از آنزیمها میتوانند نه تنها بر روی یک سوبسترای معین اثر کنند، بلکه قادرند بر روی تمام موادی که دارای یک عامل شیمیایی هستند، موثر باشند. در این صورت کلیدی را که مثال زدیم میتوان به شاه کلیدی تشبیه کرد که قادر است تمام قفل درهای یک راهرو را باز کند.نامگذاری آنزیمها
در گذشته اسامی آنزیمها بر پایه تخصص آنها یا توان عملشان بر روی یک ماده خاص انتخاب میشد. آنزیمهایی که پلی پپتیدها را به قطعات کوچکتری از زنجیرههای پپتیدی یا به اسیدهای آمینه تجزیه میکنند، بطور کلی پروتئینازها ، نامیده میشوند و ... .در حال حاضر نامگذاری جدید آنزیمها بطور رسمی بر بنای پیشنهادات کنفرانسهای بینالمللی بیوشیمی صورت میگیرد. در تقسیمبندی جدید آنزیمها را بر حسب واکنشهای شیمیایی که رهبری میکنند، به 6 گروه تقسم بندی میکنند: اکسیدو ردوکتازها - ترانسفرازها - هیدرولازها - لیازها - ایزومرآزها و لیگازها.
چشم انداز بحث
مطالعه آنزیمها دارای اهمیت عملی بیاندازه است. بسیاری از بیماریها بخصوص ناهنجاریهای ژنتیکی ارثی ممکن است به علت عبور یا عدم وجود یک یا چند آنزیم باشد. در مورد حالات دیگر بیماری علت ممکن است افزایش فعالیت یک آنزیم باشد. اندازهگیری فعالیت آنزیمها در پلاسما ، گویچههای قرمز خون یا نمونههای بافتی در تشخیص بعضی از بیماریها دارای اهمیت است. بسیاری از داروها اثر خود را از طریق انجام واکنش با آنزیمها اعمال میکنند. آنزیمها ابزار عملی مهمی در پزشکی ، صنعت شیمی ، پردازش مواد غذایی و کشاورزی هستند.
دورههای تکامل علم و تکنولوژی
 عنوان نیروی هدایتگر عمل میکردند. عصر حاضر، عصر ارتباطات است که در این عصر ایدهها و در واقع بصیرت و دوراندیشی است که به عنوان نیروی محرک در همه زمینههای تحقیقاتی عمل میکند.
عنوان نیروی هدایتگر عمل میکردند. عصر حاضر، عصر ارتباطات است که در این عصر ایدهها و در واقع بصیرت و دوراندیشی است که به عنوان نیروی محرک در همه زمینههای تحقیقاتی عمل میکند.چرخه عمر تکنولوژیها
همانطور که ملاحظه میشود در دورهای که از سال 1990 شروع و تا 2050 ادامه دارد نانوتکنولوژی به عنوان یک عامل تعیینکننده در همه تحقیقات اعم از صنعتی و غیرصنعتی ایفای نقش میکند.
در تعریف نانوتکنولوژی میتوان گفت زمینهای است که در آن دانشمندان سعی در دستکاری مواد در سطح فرامولکولی (Supera molecular) دارند که این فرایند منجر به ساخت مواد کاملاً جدید با خواص و عملکرد کاملاً جدید خواهد شد. نظیر موادی که در عین سبکی، فوقالعاده محکم، مقاوم و هوشمند هستند.
البته میتوان گفت که در این تکنولوژی جدید، علم شیمی هم نقش ایفا میکند. در واقع شیمی و مواد شیمیایی در تعامل با علوم مولکولی هستند و به عبارتی دیگر شیمی در سطح نانوشیمی در این تکنولوژی جدید ایفای نقش میکند.
البته نانوتکنولوژی به دو صورت در زمینه تحقیقات شیمیایی در آینده تأثیرگذار است: یکی سودآور کردن فرایندهای شیمیایی و دیگری نوآوری در صنایع شیمیایی.
آینده صنایع پلیمری و مواد پلیمری
یکی از روندهای مؤثر بر صنایع پلیمری آن است که شرکتها از کسب و کار (Business) مواد به سوی کسب و کار علوم زندگی((Life sciences در حال سوق یافتن هستند.روند دیگر حرکت به سمت تولید قطعات و محصولات پلیمری به طور انبوه است؛ در واقع صرف مواد پلیمری تولید نمیشوند بلکه محصولات پلیمری به صورت قطعات ساخته شده ارائه میشوند. در این میان تولید پلیمرهای با کارایی بالا (High performance) و پلیمرهای عاملدار (Functional) که نقش تعیینکنندهای در صنایع شیمیایی دارند، همچنان مورد توجه زیاد
بنابراین در جمعبندی مطالب بالا میتوان گفت که در آینده سود حاصل از کسب و کار پلیمرها، از قطعات ساخته شده از آنها حاصل میشود و نه لزوماً از خود مواد پلیمری.
نقش R&Dها در سودآورکردن صنایع شیمیایی
مرکز تحقیق و توسعه (R&Dها) با افزایش بازدهی از طریق بهبود فرآیند و تکرار پذیرکردن از طریق به حداقل رساندن خطا، استفاده از منابع تجدیدپذیر و مصرف کمتر انرژی، صنایع شیمیایی را حمایت میکنند. ابزار رسیدن به این هدف به وسیله بیوتکنولوژی و نانوتکنولوژی ایجاد خواهد شد.
به طور کلی فرض ما در ارائه یک دورنما برای صنایع پلیمری و تجارت مواد پلیمری بر این است که:
- اگرچه باریکبینی در فعالیتها ممکن است در کوتاهمدت به علت افزایش ارزش سهام مفیدتر باشد، ولی در درازمدت ممکن است به دلیل جلوگیری از نوآوری زیانبار باشد.
- در آینده شرکتهای هیبرید (Hybrid) توسعه پیدا خواهند کرد و به خاطر وجود امکانات متنوع و بهکارگیری مهارتهای غیر معمول، نوآورترین شرکتهای تحقیقات پلیمری خواهند بود.
- علوم مواد (Material sciences) و علوم زندگی (Life sciences) در آینده فرصتهای زیادی را جهت نوآوری ایجاد میکنند که در این راستا لازم است یک تعامل و تعادل صحیح بین این علوم به وجود آید. در واقع میتوان گفت که برآیند تحقیقات حاصل در زمینه بیوتکنولوژی و نانوتکنولوژی، تعیینکننده آینده تحقیقات پلیمری خواهد بود.
طبیعت و دستاوردهای مصنوعی
طبیعت نقش مؤثری در هدایت ما ایفا میکند. با دقیق شدن در طبیعت مثلاً در مورد گیاهان، در چگونگی و نحوه قرارگرفتن استخوانهای جانوران و انسانها، در ساختار ماهیچهها و غیره، در همه اینها عمل بهینهسازی (Optimise) به خوبی مشاهده میشود
 .
.مقایسه مواد طبیعی و سنتزی
در مواد سنتزی انتخاب اجزا بر اساس قیمت است ولی در مواد طبیعی انتخاب اجزا بر اساس بازیافت کامل آنها و کمترین انرژی مورد نیاز برای ایجادشان است. مواد طبیعی دارای خواص ساختاری بسیار مناسبی هستند و کنترل دقیقی در سطوح مولکولی آنها انجام میگیرد؛ بهینهترین طراحی ماکروسکوپیک در آنها صورت گرفته است. در حالیکه در مواد سنتزی تمرکز روی بهینه کردن یک جنبه خاص صورت میگیرد. در مواد سنتزی ممکن است که ما مواد را ساده و سریع مثلاً با یک قالبگیری تزریقی ایجاد کنیم ولی با نظم فرامولکولی سازگاری ندارند.
در نهایت موارد زیر را میتوان از طبیعت آموخت:
بازیافت کامل مواد
کنترل در سطح مولکولی
نظم بخشیدن در سطح نانو
 پلیمرهای عاملدار با فرایند پذیری وخواص ساختاری خوب
پلیمرهای عاملدار با فرایند پذیری وخواص ساختاری خوبهمافزایی بین علوم مواد و علوم زندگی
همافزایی بین علوم مواد و علوم زندگی باعث میشود که:
الف) ما از جعبهابزار علوم زندگی (بیوتکنولوژی، Fermentation، Enzymology ) استفاده میکنیم:
- برای تولید منومرها یا پلیمرها
- برای اصلاح و عاملدار سازی پلیمرها
ب) از جعبه ابزار علوم مواد برای کاربردهای علوم زندگی استفاده میکنیم:
- بستهبندیهای هوشمند
- برای تولید پلیمرهای زیستسازگار و قابل بازیافت در طبیعت
به سوی نانوتکنولوژی مولکولی
بررسیها نشان میدهند که تحقیقات ما زمانی در سطح ماکرو و بعد میکرو بود و اکنون در سطح نانو است. در واقع جهتگیری ما از سال 1950 تا 2050 بهسمت نانوتکنولوژی است و علوم آینده در این راستا قرار میگیرند. باید به جهتگیری خود توجه کنیم و وضعیت آینده را در نظر بگیریم. مثلاً در کارخانجات فعلی، هر بار محصول متفاوتی با فرآیند متفاوت تولید میکنیم، به مصرف انرژی و مواد اولیه زیادی نیاز داریم و ضایعات فراوان است. ولی در صنایع آینده سیستم عوض میشود و گیاهان به عنوان کارخانجات تولید کننده عمل خواهند کرد. سیستمها از طریق آنزیمها کنترل میشوند و توجه ما به حرکت تکتک مولکولها در طی یک فرآیند معطوف خواهد شد.
نتیجهگیری کلی
درست پرداختن به پدیدهها در پلیمرها، طراحی و سنتز پلیمرهایی که در آنها مجموعهای از باندهای هیدروژنی وجود دارد و ساخت سیستمهای ایدهآل باعث میشود که محدودیتهای ژنتیکی برداشته شود. سنتز پلیمرها به سمت آنهایی که حلال (Media) آنها آب است گرایش پیدا خواهند کرد و کاربرد پلیمرها، در ساخت ابزارهای پلاستیکی الکترونی که حجم بالایی از مواد نیمههادی را ایجاد میکنند، افزایش پیدا خواهد کرد.
شرکتهای هیبرید ایجاد شده، توسعه مییابند و این شرکتها برای ایجاد تعادل و تعامل صحیح بین تمرکزگرایی و تنوعگرایی نقش بسیار مهمی را ایفا میکنند.
تصور ما بر اینست که همراهی علوم مواد و علوم زندگی میتوانند فرصتهای بیشماری را در آینده برای تحقیقات فراهم آورند و بیشترین فرصتها و رقابتها در جهش به سمت پیچیدگی بیشتر مواد سنتزی ایجاد خواهد شد و نهایتاً فرامولکولهای پلیمری بر پایه پیوندهای هیدروژنی، در آینده بیشترین زمینه تحقیقات و پیشرفت را فراهم خواهند نمود.





