قابل توجه اساتید - دانشجویان دکتری و ارشد شیمی آلی
برای دیدن کنفرانس های تیم کیمیستری (Thieme Chemistry Sponsor page) به لینک زیر مراجعه نمایید.
مثلاْ این کنفرانس : http://www.esoc2011.com/
بد نیست این لینک را هم ببینید: http://www.14acc.org/regis.htm
بزرگترین کنفرانس شیمی آسیا در سال 2011
این جزوه یکی از استادان امیر کبیر به زبان ساده به همراه یک تمرین ابتدایی
از اوایل آن .
قبلش فونتهای نازنین و تیتر رو نصب کنید
در ابتدا با مفاهیم زیر آشنا می شویم :
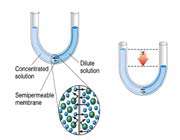
- غشای نیمه تراوا : غشایی که نسبت به بعضی از اجزای محلول نفوذ پذیر و نسبت به سایرین غیر نفوذ پذیر است. مثل غشاهای سلولی و سلوفان.
- اسمز : حرکت اجزاء از محلولی با غلظت بیشتر به طرف محلولی با غلظت کم تر.
اگر این حرکت را برای حلال در نظر بگیریم می شود، حرکت حلال از محلولی با غلظت حل شونده ی کم تر به سمت محلولی حاوی غلظت حل شونده ی بیشتر.
- محلول ایزوتونیک : محلولی با فشار اسمزی یکسان در دو طرف یک غشای نیمه تراوا.
- محلول هیپوتونیک : محلولی با فشار اسمزی ای کم تر از محلول هیپرتونیک که دارای فشار اسمزی بالایی است.
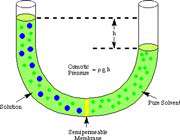
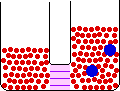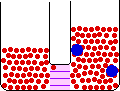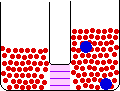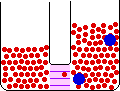
اگر لوله ی U شکل زیر را در نظر بگیرید:
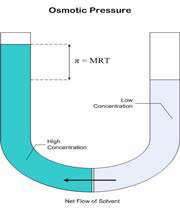
حلال از بازوی سمت راست که دارای محلول رقیق است ( غلظت حلال بیشتر است ) به طرف محلول غلیظ ( محلول شامل آب و نمک ) واقع در بازوی سمت چپ، از طریق غشای نیمه تراوا در حال حرکت است. بنابراین رفته رفته مقدار آب در بازوی سمت چپ افزایش می یابد و محلول رقیق تر می گردد و سطح مایع در لوله بالاتر می رود. در این جا اختلاف فشار به صورت اختلاف ارتفاع در دو سمت بازو ایجاد می شود که به صورت فشار ![]() در شکل ظاهر شده است. این فشار را فشار اسمزی می نامند.
در شکل ظاهر شده است. این فشار را فشار اسمزی می نامند.
فشار اسمزی به صورت زیر توسط جاکوب وانت هوف ( Jacobus Henricus van"t Hoff ) فرمول بندی شده است: